- Recherche et pratique
Actualités en oncologie: la thérapie par cellules CAR-T
Dans la thérapie par cellules CAR-T, les cellules immunitaires reprogrammées se lient aux cellules cancéreuses et les détruisent de manière ciblée. La recherche actuelle porte sur l’extension des options thérapeutiques.
20.08.2024
La thérapie par cellules CAR-T (chimeric antigen receptor T-cell therapy) est une approche novatrice dans le traitement du cancer. Elle a connu un développement fulgurant au cours des dernières années. Les débuts de la thérapie par cellules CAR-T remontent aux années 80 lorsque de premiers essais pour modifier génétiquement des cellules T ont été réalisés. Au cours des décennies suivantes, la technologie a été continuellement développée et optimisée de manière à pouvoir l’utiliser pour le traitement du cancer dans des centres spécialisés. A l’heure actuelle, le traitement est en premier lieu utilisé contre certaines hémopathies (leucémies, lymphomes et myélomes). Mais compte tenu du développement fulgurant, le traitement peut progressivement être appliqué pour les tumeurs solides ainsi que pour les maladies auto-immunes.
Principe d’action de la thérapie
Les cellules CAR-T sont en principe obtenues à partir de lymphocytes T autologues. Leur fonction naturelle, c’est-à-dire la détection d’une structure cible (appelée complexe majeur d’histocompatibilité, CMH) sur des cellules étrangères ou tumorales au moyen de leur récepteur des lymphocytes T, n’est pas modifiée. En introduisant un domaine d’anticorps lié à la membrane (appelé récepteur CAR), on obtient une reprogrammation des cellules T en dehors du corps. Si le domaine d’anticorps reconnaît par exemple un antigène tumoral, les cellules CAR-T peuvent, après s’être liées à la cellule tumorale, déclencher une série de processus immunologiques et provoquer la destruction de cette dernière.
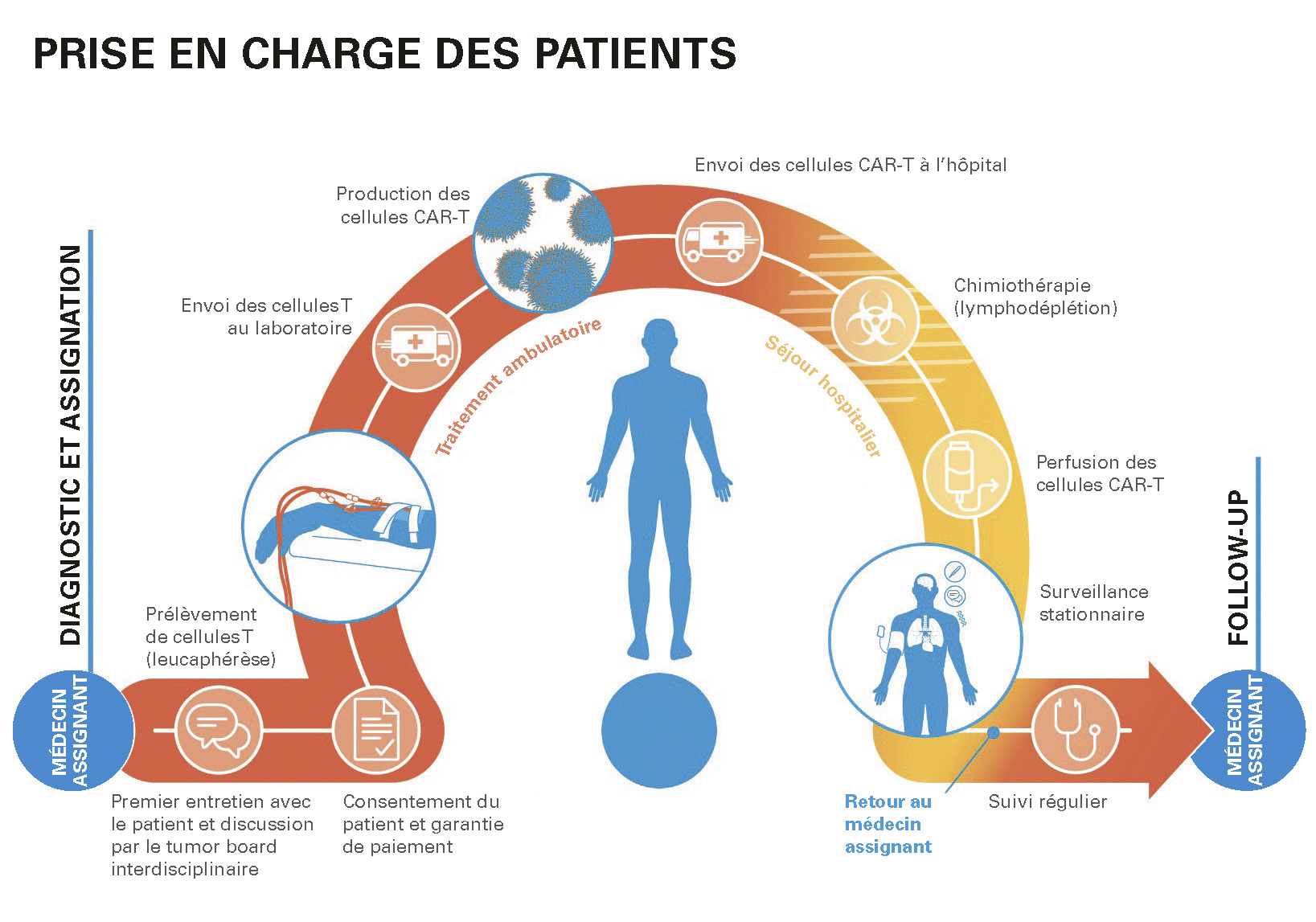
Processus de production des cellules CAR-T
La production de cellules CAR-T est un processus complexe en plusieurs étapes (fig. 1):
- 1. Aphérèse: prélèvement de leucocytes, c’est-à-dire de cellules T (lymphocytes T) dans le sang de la patiente ou du patient.
- 2. Modification génétique: les cellules T sont modifiées génétiquement en laboratoire de manière à exprimer un récepteur CAR spécifique aux tumeurs sur leur surface.
- 3. Expansion et activation: les cellules CAR-T sont mises en culture pour une expansion in vitro et activées.
- 4. Perfusion: après un contrôle de qualité, le laboratoire renvoie les cellules CAR-T à la clinique où elles sont réinjectées à la patiente ou au patient.
Autorisation et champ d’application
La première thérapie par cellules CAR-T, Kymriah, a été autorisée aux Etats-Unis en 2017 pour le traitement de la leucémie lymphoblastique aiguë (LLA) chez les enfants et adolescents. Au cours des années suivantes, d’autres indications ont été autorisées dans le traitement des lymphomes à cellules B et du myélome multiple.
Les six produits CAR-T suivants sont actuellement autorisés en Suisse [1]:

Effets secondaires: de modérés à graves
La thérapie par cellules CAR-T peut être associée à différents effets secondaires modérés à graves [2]. Parmi les effets secondaires les plus fréquents figurent:
- Syndrome de libération de cytokines (CRS): le CRS est une réaction inflammatoire systémique qui peut être accompagnée de fièvre, de céphalées, de nausées et de vomissements.
- Neurotoxicité (ICANS): la neurotoxicité peut se manifester sous forme de confusion, d’aphasie, de convulsions et de coma.
- Hypogammaglobulinémie: une hypogammaglobulinémie est souvent associée à un risque d’infection accru et doit être traitée en cas d’infections à répétition par une substitution d’immunoglobulines.
Chances de succès du traitement
Pour les principales indications chez l’adulte (rr LDGCB, rr MM et rr LCM), on dispose sur la base des données d’études, mais aussi de données dites du monde réel, de chiffres solides concernant la réponse, la durée de la réponse et les chances de guérison. Dans ce contexte, les lymphomes et les myélomes se distinguent comme suit:
- La survie globale (OS) est de 35 à 50% chez les patients rr LDGCB et de près de 60% chez les patients rr LCM. Si l’on tient compte du fait que les patients rr LDGCB ou rr LCM n’avaient jusqu’ici aucune ou qu’une très faible chance de guérir (10 à 15%) en cas de récidive, les données relatives aux cellules CAR-T peuvent être considérées comme un développement pertinent de notre éventail thérapeutique [3, 4, 5].
- Dans le traitement de patients rr MM, la thérapie par cellules CAR-T permet d’obtenir des taux de réponse très élevés (souvent >80%) avec une survie sans progression (SSP) en partie très longue, dépassant deux ans. Jusqu’ici, rien n’indique hélas que l’on puisse obtenir une guérison à long terme. La thérapie par cellules CAR-T chez les patients rr MM permet donc de prolonger la vie, mais pas de les guérir [6].
Perspectives et développements futurs
Parmi les principaux objectifs de développement de la thérapie par cellules CAR-T figurent:
- Cibler de nouveaux types de cancer: élargir l’utilisation de cellules CAR-T pour combattre les tumeurs solides, en plus des lymphomes, myélomes et leucémies.
- Cellules CAR-T universelles: développer des thérapies «prêtes à l’emploi». Pour ce faire, on recourt à des cellules T d’un donneur en bonne santé, les intègre dans le récepteur CAR, multiplie les cellules T en grandes quantités et les stocke. Cela permet ensuite d’utiliser des cellules CAR-T d’un donneur (allogène) en cas de maladie et évite de devoir utiliser des cellules T autologues de la patiente ou du patient.
- Réduction des effets secondaires: minimiser les risques tels que le syndrome de libération de cytokines et améliorer la tolérance. De premières études montrent qu’un traitement ambulatoire est envisageable.
- Thérapies combinées: combiner les cellules CAR-T avec d’autres traitements immunologiques pour améliorer l’efficacité.
- Traitement de maladies auto-immunes: les cellules CAR-T ciblant l’antigène CD19 peuvent aussi éliminer les cellules B autoréactives et ainsi par exemple traiter efficacement les maladies auto-immunes à cellules B, comme cela a été récemment démontré avec une patiente atteinte de lupus érythémateux disséminé (LED) [7].
Conclusion
La thérapie par cellules CAR-T est une approche novatrice et prometteuse dans le traitement du cancer, qui a permis d’obtenir des résultats impressionnants chez des patientes et patients atteints d’un cancer avancé. La recherche dans ce domaine est très dynamique. On s’attend donc à ce que d’autres améliorations de la technologie impliquant une utilisation clinique plus large soient réalisées dans les années à venir. Le but est d’améliorer l’efficacité et aussi la tolérance, ce qui permettrait d’effectuer la thérapie dans un cadre ambulatoire.
Bibliographie
- https://www.swissmedic.ch/swissmedic/fr/home/medicaments-a-usage-humain/authorisations/new-medicines.html
- Yakoub-Agha I, Chabannon C, Bader P, et al. Management of adults and children undergoing chimeric antigen receptor T-cell therapy: best practice recommendations of the European Society for Blood and Marrow Transplantation (EBMT) and the joint accreditation committee of ISCT and EBMT (JACIE). Haematologica. 2020;105(2):297–316.
- Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene Ciloleucel CAR-T cell therapy in refractory large B-cell lymphoma. N Engl J Med. 2017;377(26):2531–44.
- Wang M, Munoz J, Goy A, et al. KTE-X19 CAR-T cell therapy in relapsed or refractory mantlecell lymphoma. N Engl J Med. 2020a;382:1331–42.
- Schuster SJ, Bishop MR, Tam CS, Waller EK, Borchmann P, McGuirk JP, et al. Tisagenlecleucel in adult relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med. 2019b;380:45–56.
- Munshi NC, Anderson LD Jr, Shah N, Madduri D, Berdeja J, Lonial S, Raje N, Lin Y, Siegel D, Oriol A, et al. Idecabtagene Vicleucel in relapsed and refractory multiple myeloma. N Engl J Med. 2021;384(8):705–16
- Mackensen A, Müller F, Mougiakakos D, Böltz S, Wilhelm A, Aigner M, Völkl S, Simon D, Kleyer A, Munoz L, Kretschmann S, Kharboutli S, Gary R, Reimann H, Rösler W, Uderhardt S, Bang H, Herrmann M, Ekici AB, Buettner C, Habenicht KM, Winkler TH, Krönke G, Schett, G. Anti-CD19 CAR T cell therapy for refractory systemic lupus erythematosus. Nat Med. 2022 Oct;28(10):2124-2132. doi: 10.1038/s41591-022-02017-5. Epub 2022 Sep 15. Erratum in: Nat Med. 2022 Nov 3; PMID: 36109639.