- Forschung und Praxis
Genom-Engineering: inspiriert von der Natur
Das Potenzial des CRISPR-Cas-Systems reicht weit über seine natürliche Fähigkeit hinaus, Doppelstrangbrüche an spezifischen Stellen im Genom zu erzeugen. Dies eröffnet zahlreiche Anwendungsmöglichkeiten, bringt jedoch auch einige Herausforderungen mit sich.
11.02.2025

Mikroorganismen können in harschen Lebensräumen nicht nur überleben, sondern auch gedeihen. Um Bedrohungen wie Phagen zu bekämpfen, haben sie Abwehrmechanismen wie Restriktionsenzyme entwickelt, die fremde DNA gezielt zerstören, während sie ihre eigene verschonen. Die Entdeckung dieser Enzyme, angeführt vom Schweizer Mikrobiologen Werner Arber in den 1960er-Jahren, löste eine Revolution in der Molekularbiologie aus und ermöglichte die rekombinante DNA-Technologie. Die kurzen Erkennungssequenzen der Restriktionsenzyme begrenzten jedoch die direkte Anwendung in Zellen. Zudem war es zu dieser Zeit auch äusserst schwierig, sie weiter zu modifizieren, da das Vorhersagen und Überprüfen des Effekts einer Aminosäurenänderung mit den damaligen Methoden praktisch unmöglich war. Jedoch wies ein Teil der Restriktionsenzyme klar getrennte Domänen für die DNA-Erkennung und das DNA-Schneiden auf, sodass diese leicht separiert werden konnten. Dies inspirierte die ersten Werkzeuge zur Genom-Editierung, indem eine DNA-schneidende Domäne eines Restriktionsenzyms mit der Sequenzerkennungsdomäne von Transkriptionsfaktoren kombiniert wurde. In den frühen 2010er-Jahren rückte ein weiteres bakterielles Abwehrsystem, CRISPR-Cas (clustered regularly interspaced short palindromic repeats, CRISPR associated protein), ins Zentrum der Aufmerksamkeit und etablierte sich schnell als leistungsfähiges, vielseitiges und skalierbares Werkzeug zur Genom-Editierung.
Ein einfaches System mit vielen Möglichkeiten
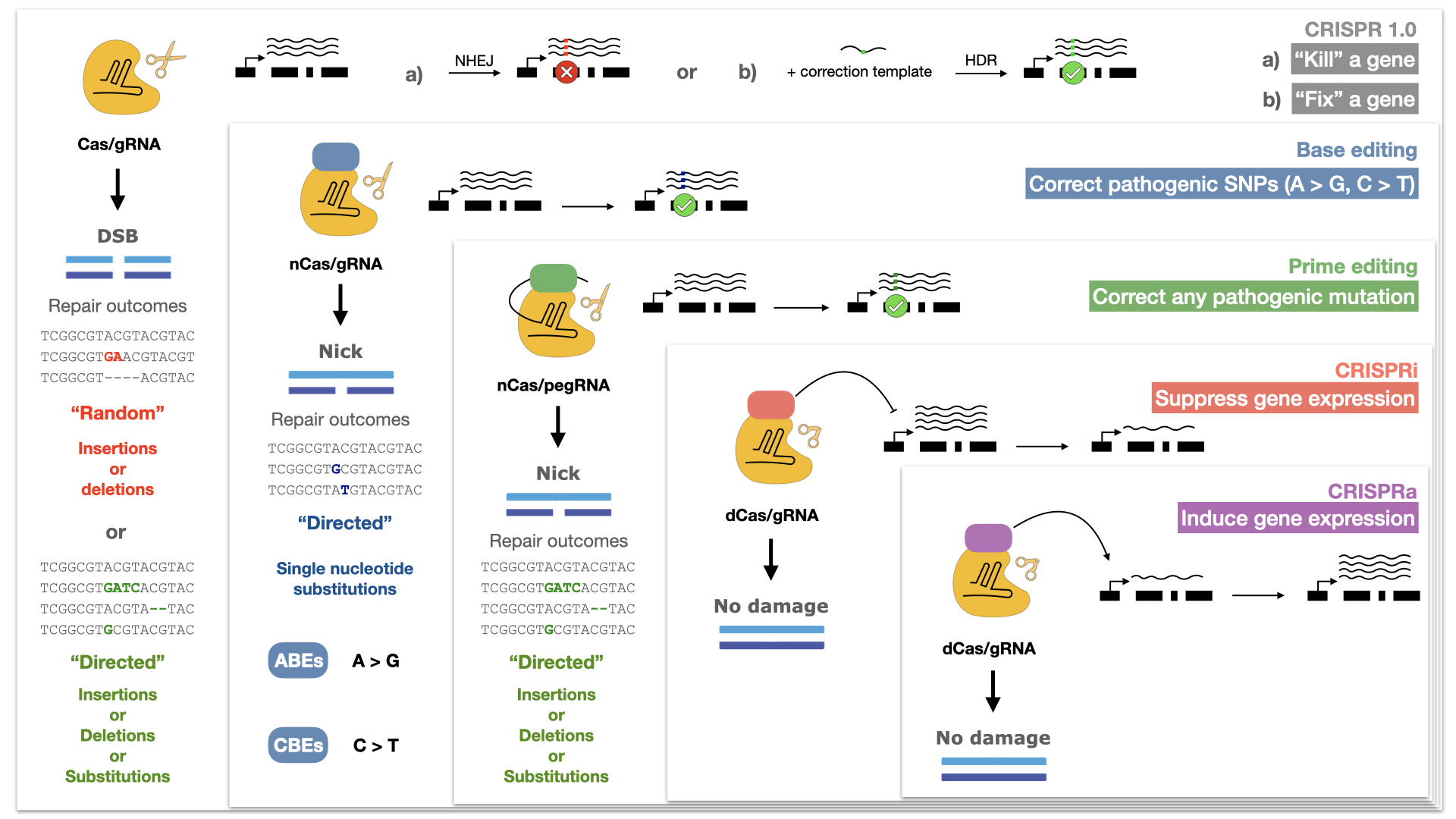
Was macht das CRISPR-Cas-System jedoch so einzigartig? In seiner einfachsten biotechnologischen Form besteht das CRISPR-Cas-System aus zwei Teilen: dem Cas-Protein, das die Fähigkeit zum Schneiden der DNA besitzt, und einer Guide-RNA (gRNA), welche die Fähigkeit zur Erkennung von spezifischen DNA-Sequenzen hat. Im Gegensatz zu seinen proteinbasierten Vorgängern ist das Design einer gRNA zur gezielten Erkennung spezifischer Genom-Stellen äusserst unkompliziert, ähnlich wie das Zusammenfügen eines vierteiligen Puzzles: Man verwendet «A», um «T» zu erkennen; «G» für «C»; «U» für «A» und «C» für «G». Sobald das Cas-Protein von der gRNA zur definierten Ziel-Sequenz geleitet wurde, kann es einen Doppelstrangbruch in der DNA erzeugen. Zellen tolerieren solche Brüche in ihrer DNA nicht; sie erkennen und reparieren diese schnell, um die Unversehrtheit des Genoms wiederherzustellen. Dieser Reparaturprozess kann manchmal zu Fehlern führen, und Forschende nutzen diese natürlichen Fehler aus, um die lokale Sequenz zufällig zu verändern und ein Gen auszuschalten. Eine andere Strategie besteht darin, den Reparaturprozess zu manipulieren, um gezielt spezifische Sequenzen nach Wahl einzufügen. Obwohl beide Veränderungen auch mit früheren Generationen von Genom-Editierungs-Werkzeugen möglich waren, hat es die einfache Gestaltung von CRISPR-Cas mehr Forschenden ermöglicht, dieses System zu erforschen, weiterzuentwickeln und es von einem Werkzeug zur Genom-Editierung zu einer vielseitigen Plattform für Genom-Engineering auszubauen.
Von CRISPR 1.0 zur nächsten Generation des Genom-Engineerings
Wissenschaftlerinnen und Wissenschaftler erkannten schnell, dass der Wert von CRISPR-Cas über seine natürliche Fähigkeit, Doppelstrangbrüche an spezifischen Stellen im Genom zu erzeugen, hinausgeht. Stattdessen nutzten sie es als Transporter, um andere Regulatoren oder Enzyme an gewünschte Positionen im Genom zu befördern. Beispielsweise tragen katalytisch beeinträchtigte Varianten von Cas, die zwar DNA binden, aber nicht schneiden können, Proteine, welche die Transkription an bestimmten Stellen im Genom hemmen oder aktivieren (CRISPRi und CRISPRa). Andere modifizierte Varianten haben Enzyme gebunden, die einzelne Nukleotide wie «C» oder «A» chemisch verändern und sie in «T» bzw. «G» umwandeln (Cytidin- und Adenin-Basen-Editoren). Kürzlich entwickelte Prime-Editoren kombinieren eine speziell modifizierte gRNA, die auch die gewünschte genomische Veränderung beinhaltet, mit einer Reversen Transkriptase, also einem Enzym, das die RNA zu DNA transkribiert. Dies erlaubt das Einsetzen eines gewünschten DNA-Fragments in das Genom. Weitere Bemühungen konzentrierten sich auf das «Genome Mining» mikrobieller Gemeinschaften, um neue Cas-Enzyme mit interessanten Eigenschaften zu entdecken; so etwa die Fähigkeit, RNA statt DNA zu binden und zu schneiden. Solche Cas-Proteine ermöglichen es uns nun, das Transkriptom zu bearbeiten und zu modulieren. Dies eröffnet neue Möglichkeiten zur temporären Genregulation, da die Änderung auf der RNA-Stufe die Genexpression beeinflusst, ohne die zugrunde liegende DNA-Sequenz zu verändern.
Anwendungen: Nutzpflanzen, Recycling und genetische Krankheiten
Das Konzept der Genom-Modifikation wurde insbesondere von zwei Zielen angetrieben: dem Verstehen der Genfunktion und der Kontrolle des zellulären Verhaltens. Die Vielzahl an Manipulationen, die durch CRISPR-Cas möglich sind, erlaubt es, spezifische Sequenzen zu verändern, um phänotypische Effekte zu untersuchen und Erkenntnisse darüber zu gewinnen, wie genetische Informationen die Entwicklung und Funktion einzelner Zellen steuern. Ausserdem ermöglicht es Forschenden, Zellen und Organismen mit neuen Eigenschaften für biotechnologische Anwendungen zu entwickeln (z. B. resistente Nutzpflanzen, Produktion von Enzymen und anderen Makromolekülen, Recycling von Materialien, Bekämpfung von Tumoren etc.) und fehlende Funktionen in Zellen und Organismen wiederherzustellen, um genetische Krankheiten zu behandeln.
Ein Hub sichert Zugang für Forschung und Medizin
Die schnellen Fortschritte im Genom-Engineering bergen das Risiko, dass eine Lücke zwischen der Technologieentwicklung und den vielen potenziellen klinischen oder biotechnologischen Anwendungen entsteht. Unser Labor an der ETH Zürich fungiert als Technologie-Hub, der diese Lücke schliessen und sicherstellen soll, dass Spitzentechnologien sowohl für Forschende als auch für Medizinerinnen und Mediziner zugänglich bleiben.
Ausgeklügelte Ansätze: ein Antierschöpfungssensor
Eines unserer Interessengebiete ist die Gen- und Zelltherapie. Während die Gentherapie darauf abzielt, genetische Defekte zu korrigieren, werden bei der Zelltherapie modifizierte Zellen als therapeutisches Mittel eingesetzt. Stammzellen können beispielsweise geschädigtes Gewebe regenerieren, und CRISPR-Cas-modifizierte Zellen können aktiv Krankheiten behandeln. Ein Beispiel für das Potenzial der CRISPR-Cas-basierten Zelltherapie ist die CAR-T-Zelltherapie, bei der Immunzellen so umprogrammiert werden, dass sie gezielt Krebszellen angreifen. Diese hat bereits vielversprechende Ergebnisse bei flüssigen Tumoren wie der B-Zell-Leukämie gezeigt und bietet eine Option, wenn herkömmliche Behandlungen versagen. Bei soliden Tumoren ist sie jedoch weniger erfolgreich. Dies aufgrund eines Phänomens, das als T-Zell-Erschöpfung bekannt ist – ein dysfunktionaler Zustand, der durch eine verringerte Zellteilung, Zytokinproduktion und Tötungskapazität gekennzeichnet ist und die Immunantwort sowie die Wirksamkeit der Behandlung schwächt. Strategien zur Verhinderung dieses Erschöpfungszustands und zur Steigerung der Effizienz der CAR-T-Zelltherapie beinhalten die Inaktivierung des hemmenden Rezeptors PD-1 mithilfe der CRISPR-Knockout-Technologie, wobei derzeit ehrgeizigere Ansätze untersucht werden. Das T-FITNESS-Konsortium, finanziert von der EU und der Schweiz, zielt darauf ab, erschöpfungsresistente T-Zellen zu entwickeln, indem ein Antierschöpfungssensor integriert wird. Sobald die Zellen «erkennen», dass sie kurz davor stehen, in diesen dysfunktionalen Zustand zu geraten, aktivieren sie ein «Ruhe»-Programm, das es ihnen ermöglicht, bald darauf wieder den Tumor zu bekämpfen. Die therapeutische Anwendung einer so ausgeklügelten Kontrolle des Zellverhaltens wäre ohne die modernen Werkzeuge, die CRISPR-Cas zur wirksamen und sicheren Genom-Modifikation bietet, nicht vorstellbar gewesen.
Ein Blick in die Zukunft
CRISPR-Cas beschleunigt die Grundlagenforschung, und je besser wir verstehen, wie Zellen ihr genetisches und epigenetisches Material nutzen, um Entscheidungen zu treffen, desto mehr Wege können wir finden, um in krankhafte Prozesse einzugreifen. Gleichzeitig ermöglichen Fortschritte in der künstlichen Intelligenz nun die Gestaltung und das Testen von Enzymen mit verbesserten Eigenschaften, was das therapeutische Potenzial von CRISPR-Cas möglicherweise erweitert. Trotz dieses vielversprechenden Potenzials stehen wichtige Herausforderungen an, bevor das System in der klinischen Praxis weit verbreitet eingesetzt werden kann, und verschiedene Akteure investieren viel Energie, um diese Herausforderungen zu bewältigen.
- So erfreulich die Entwicklungen auch sind, das schnell wachsende CRISPR-Feld könnte schwer überschaubar werden. Umso wichtiger ist deshalb eine enge Zusammenarbeit zwischen Biologie und Medizin, um Technologien zu priorisieren, Anstrengungen zu bündeln und Barrieren für die klinische Umsetzung zu beseitigen.
- Wenn Technologien vom Labor in die Klinik überführt werden, stehen die Themen Lieferung und Sicherheit im Mittelpunkt. Eine präzise und effiziente Ansteuerung eines spezifischen Gewebes im lebenden Organismus bleibt schwierig. Das Vermeiden von Off-Target-Effekten im Genom und anderen unerwünschten Nebenwirkungen ist ebenfalls ein grosses Anliegen, und unser Labor sowie andere Labore weltweit entwickeln Methoden, um die Prozesse sicherer zu bewerten und zu gestalten.
- Aus gesellschaftlicher Sicht ist es wichtig, in Bezug auf die neuesten Technologien ethische Prinzipien zu formulieren und rechtliche Defizite zu finden und zu adressieren.
- Auch die Kosten bleiben ein wichtiger und entscheidender Faktor für die Durchführung klinischer Studien und stellen daher ein Nadelöhr für die Einführung neuer Technologien dar.
Eines ist sicher: Das Potenzial von CRISPR-Cas verspricht transformative Fortschritte in der Präzisionsmedizin und bietet Hoffnung für bisher unheilbare Erkrankungen. Es liegt in unserer gemeinsamen Verantwortung, über Wissenschaft, Politik und Gesellschaft hinweg zusammenzuarbeiten, um eine verantwortungsvolle und gerechte Einführung dieser Technologie sicherzustellen, damit sie allen Mitgliedern unserer Gesellschaft zugutekommt.



