- Recherche et pratique
Ingénierie génomique: inspirée par la nature
Le potentiel de la méthode CRISPR/Cas dépasse largement sa capacité naturelle à créer des cassures double brin à des endroits définis du génome. Cela ouvre d’innombrables applications possibles, mais s’accompagne aussi de certains défis.
11.02.2025

Les microorganismes ne peuvent pas seulement survivre dans un environnement rude, mais aussi y prospérer. Pour combattre des menaces telles que les phages, ils ont développé des mécanismes de défense comme les enzymes de restriction, qui détruisent de manière ciblée l’ADN étranger, tout en protégeant leur propre ADN. La découverte de ces enzymes sous la conduite du microbiologiste suisse Werner Arber dans les années 1960 a déclenché une révolution dans la biologie moléculaire et rendue possible la technologie de l’ADN recombinant. Les courtes séquences de reconnaissance des enzymes de restriction limitaient toutefois leur utilisation directe dans des cellules. De plus, il était, à ce moment-là, très difficile de les modifier davantage, étant donné qu’il était quasi-impossible de prédire et de vérifier l’effet d’une modification d’un acide aminé avec les méthodes de l’époque. Pourtant, une partie des enzymes de restriction présentait des domaines clairement distincts pour la reconnaissance de l’ADN et la coupure de l’ADN. Il était donc facile de les séparer. Cela a été une source d’inspiration pour développer les premiers outils d’édition génomique, en combinant un domaine coupant l’ADN d’une enzyme de restriction avec le domaine de reconnaissance de facteurs de transcription. Au début des années 2010, un autre système de défense contre les bactéries, CRISPR/Cas (clustered regularly interspaced short palindromic repeats, CRISPR associated protein), s’est retrouvé au centre de l’attention et s’est rapidement établi comme un outil performant, polyvalent et évolutif pour l’édition génomique.
Un système simple aux multiples possibilités
Qu’est-ce qui rend le système CRISPR/Cas unique? Dans sa forme biotechnologique la plus simple, le système CRISPR/Cas est composé de deux éléments: la protéine Cas, qui a la capacité de couper l’ADN, et l’ARN guide (ARNg), qui a la capacité de reconnaître des séquences d’ADN spécifiques. Contrairement à ses prédécesseurs basés sur des protéines, le design d’un ARNg pour la reconnaissance ciblée de séquences génomiques spécifiques est particulièrement simple, un peu comme l’assemblage d’un puzzle à quatre pièces: on utilise «A» pour reconnaître «T»; «G» pour «C»; «U» pour «A» et «C» pour «G». Dès que la protéine Cas a été guidée par l’ARNg vers la séquence cible définie, elle peut générer une cassure double brin dans l’ADN. Les cellules ne tolèrent pas de telles cassures de leur ADN; elles les reconnaissent et les réparent rapidement pour rétablir l’intégrité du génome. Ce processus de réparation peut parfois entraîner des erreurs. Les chercheurs se servent de ces erreurs naturelles pour modifier aléatoirement la séquence locale et inactiver un gène. Une autre stratégie consiste à manipuler le processus de réparation pour introduire de manière ciblée des séquences spécifiques. Bien que les deux modifications étaient également possibles avec d’anciennes générations d’outils d’édition génomique, la simplicité de la méthode CRISPR/Cas a permis à un plus grand nombre de chercheurs d’explorer ce système, de le perfectionner et de faire d’un outil pour l’édition génomique une plateforme polyvalente pour l’ingénierie génomique.
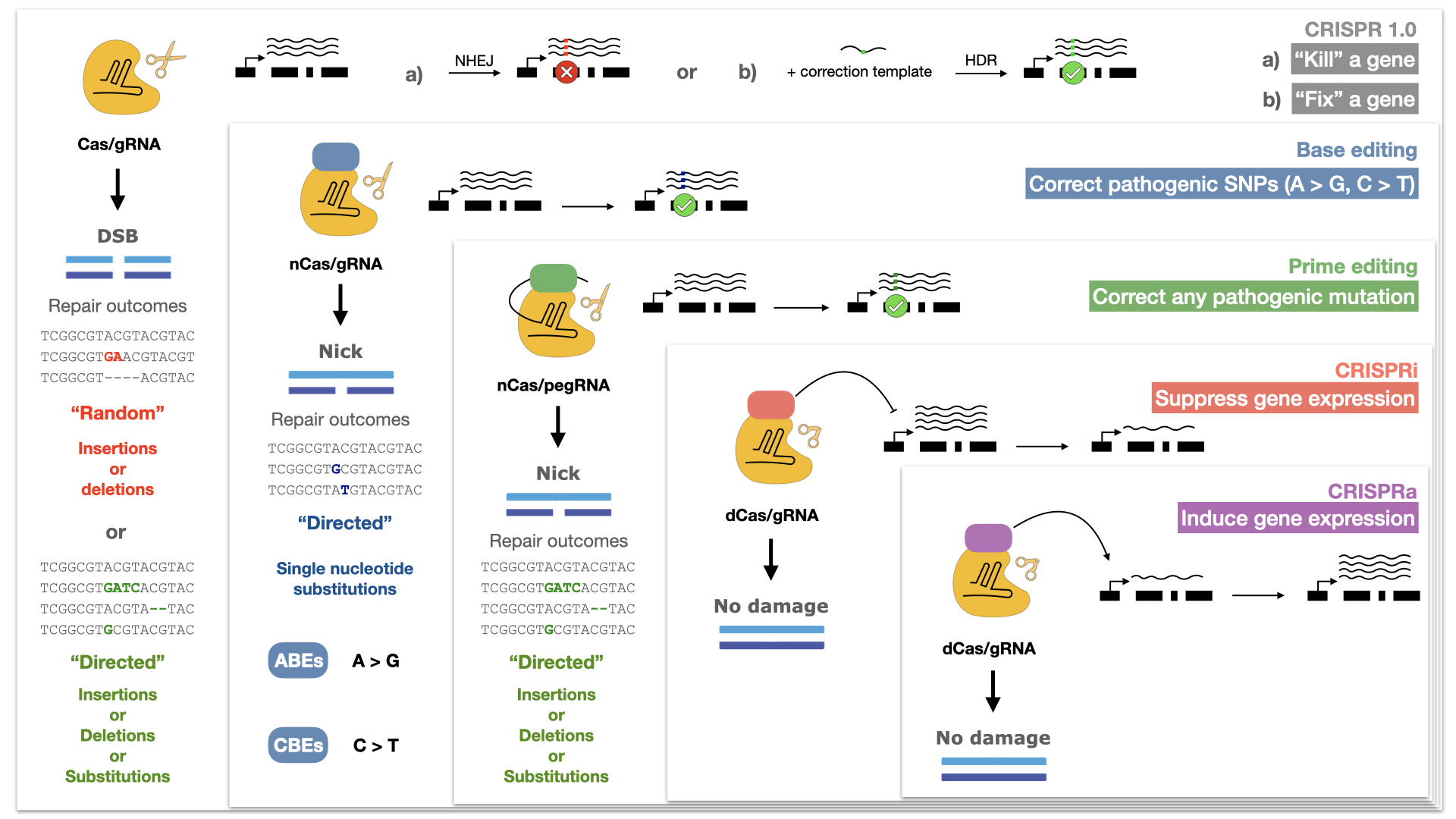
De CRISPR 1.0 à la prochaine génération de l’ingénierie génomique
Les scientifiques ont vite reconnu que la valeur de la méthode CRISPR/Cas dépassait sa capacité naturelle à générer des cassures double brin à des endroits spécifiques du génome. Au lieu de cela, ils s’en sont servis comme transporteur pour déplacer d’autres régulateurs ou enzymes vers des positions spécifiques du génome. Des variantes catalytiquement altérées de la protéine Cas, qui se lient à l’ADN, mais ne peuvent pas la couper, sont porteuses de protéines qui peuvent inhiber ou activer la transcription sur certains sites du génome (CRISPRi et CRISPRa). D’autres variantes modifiées lient des enzymes qui modifient chimiquement certains nucléotides comme «C» ou «A» et les transforment en «T» ou «G» (éditeurs de bases cytidine et adénine). Des prime editors récemment développés combinent un ARNg spécialement modifié, qui contient aussi la modification génomique souhaitée, avec une transcriptase inverse, c’est-à-dire une enzyme qui transcrit l’ARN en ADN. Cette méthode permet d’insérer le fragment d’ADN souhaité dans le génome. D’autres efforts se concentrent sur l’extraction génomique (genome mining) de communautés microbiennes dans le but de découvrir de nouvelles enzymes Cas ayant des propriétés intéressantes, comme la capacité de lier et de couper l’ARN plutôt que l’ADN. De telles protéines Cas nous permettent désormais de travailler sur le transcriptome et de le moduler. Cela ouvre de nouvelles possibilités dans le domaine de la régulation génétique temporaire, étant donné que la modification au niveau de l’ARN influence l’expression génique sans modifier la séquence d’ADN sous-jacente.
Applications: plantes vivrières, recyclage et maladies génétiques
Le concept de la modification du génome a été animé par deux objectifs en particulier: comprendre la fonction des gènes et contrôler le comportement cellulaire. Les innombrables manipulations possibles avec la méthode CRISPR/Cas permettent de modifier des séquences spécifiques pour analyser des effets phénotypiques et acquérir des connaissances sur la manière dont les informations génétiques pilotent le développement et la fonction de certaines cellules. De plus, elles permettent aux chercheurs de développer des cellules et des organismes possédant de nouvelles propriétés pour les applications biotechnologiques (p. ex. plantes vivrières résistantes, production d’enzymes et d’autres macromolécules, recyclage de matériaux, lutte contre les tumeurs) et de rétablir des fonctions défectueuses dans les cellules et les organismes pour traiter des maladies génétiques.
Une plateforme garantit l’accès pour la recherche et la médecine
Les progrès rapides dans l’ingénierie génomique présentent le risque de voir apparaître un fossé entre le développement technologique et les nombreuses applications potentielles dans le domaine clinique ou biotechnologique. Notre laboratoire à l’EPF Zurich fonctionne comme une plateforme technologique qui vise à combler ce fossé et à garantir que les technologies de pointe soient tant à la disposition des chercheurs que des médecins.
Approches ingénieuses: un capteur anti-épuisement
L’un de nos domaines d’intérêt est la thérapie génétique et cellulaire. Alors que la thérapie génétique vise à corriger des défauts génétiques, la thérapie cellulaire utilise des cellules modifiées comme moyen thérapeutique. Ainsi, des cellules souches peuvent régénérer des tissus endommagés, et des cellules modifiées par CRISPR/Cas peuvent activement traiter des maladies. Un exemple pour le potentiel de la thérapie cellulaire basée sur la méthode CRISPR/Cas est la thérapie par cellules CAR-T, où des cellules immunitaires sont reprogrammées pour attaquer de manière ciblée des cellules cancéreuses. Elle a déjà montré des résultats prometteurs pour les tumeurs liquides telles que la leucémie lymphoïde aiguë de type B et offre une option lorsque les traitements habituels demeurent inefficaces. Elle est toutefois moins efficace pour les tumeurs solides. Cela en raison d’un phénomène connu sous le nom d’«épuisement des lymphocytes T», un état dysfonctionnel caractérisé par une division cellulaire, une production de cytokines et une capacité de destruction réduites, qui affaiblit la réponse immunitaire et l’efficacité du traitement. Les stratégies pour empêcher cet état d’épuisement et augmenter l’efficacité de la thérapie par cellules CAR-T incluent l’inactivation du récepteur inhibiteur PD-1 à l’aide de la technologie CRISPR-Knockout. La recherche se penche toutefois actuellement sur des approches plus ambitieuses. Le consortium T-FITNESS, financé par l’UE et la Suisse, vise à développer des lymphocytes T résistant à l’épuisement en y intégrant un capteur anti-épuisement. Dès que les cellules «reconnaissent» qu’elles sont sur le point de tomber dans cet état dysfonctionnel, elles activent un programme de «repos» qui leur permet de rapidement reprendre leur combat contre la tumeur. L’application thérapeutique d’un contrôle aussi ingénieux du comportement cellulaire n’aurait pas été possible sans les outils modernes proposés par la méthode CRISPR/Cas permettant une modification efficace et sûre du génome.
Un regard vers l’avenir
CRISPR/Cas accélère la recherche fondamentale. Donc, mieux nous comprendrons comment les cellules utilisent leur matériel génétique et épigénétique pour prendre des décisions, plus les voies pour intervenir dans les processus pathologiques seront nombreuses. En même temps, les progrès de l’intelligence artificielle rendent désormais possible d’aménager et de tester des enzymes avec des propriétés améliorées, ce qui est susceptible d’élargir le potentiel thérapeutique de CRISPR/Cas. Malgré ce potentiel prometteur, nous sommes face à d’importants défis avant de pouvoir utiliser le système à large échelle dans la pratique clinique, et différents acteurs investissent des moyens considérables pour les surmonter.
- Les développements sont certes réjouissants, mais le champ CRISPR en pleine expansion pourrait devenir difficile à gérer. Une étroite collaboration entre la biologie et la médecine est donc d’autant plus importante pour accorder la priorité aux technologies, concentrer les efforts et éliminer les barrières pour la mise en œuvre clinique.
- Si les technologies sont transférées du laboratoire en clinique, les questions de la livraison et de la sécurité sont au centre de l’attention. Viser avec précision et efficacité un tissu spécifique dans l’organisme vivant reste difficile. Éviter les effets hors cible dans le génome et d’autres effets indésirables figure aussi parmi les préoccupations majeures, et notre laboratoire ainsi que d’autres laboratoires dans le monde développent des méthodes pour évaluer et aménager les processus de manière plus sûre.
- Du point de vue de la société, il est important de formuler des principes éthiques en référence aux technologies les plus récentes et d’identifier et combler d’éventuels vides juridiques.
- Les coûts demeurent également un facteur important et décisif pour réaliser des études cliniques et représentent donc un goulet d’étranglement pour l’introduction de nouvelles technologies.
Une chose est sûre, le potentiel de CRISPR/Cas promet des progrès de nature transformationnelle dans la médecine de précision et est synonyme d’espoir pour des maladies jusqu’ici incurables. Il relève de notre responsabilité à tous de collaborer au-delà de la science, de la politique et de la société pour garantir une introduction responsable et équitable de cette technologie, afin qu’elle profite à tous les membres de notre société.