- Forschung und Praxis
Aktuelles zur Onkologie: die CAR-T-Zelltherapie
Bei der CAR-T-Zelltherapie binden sich umprogrammierte körpereigene Abwehrzellen an die Tumorzellen und können sie so gezielt vernichten. Aktuell wird intensiv an einer Erweiterung der Therapiemöglichkeiten geforscht.
20.08.2024
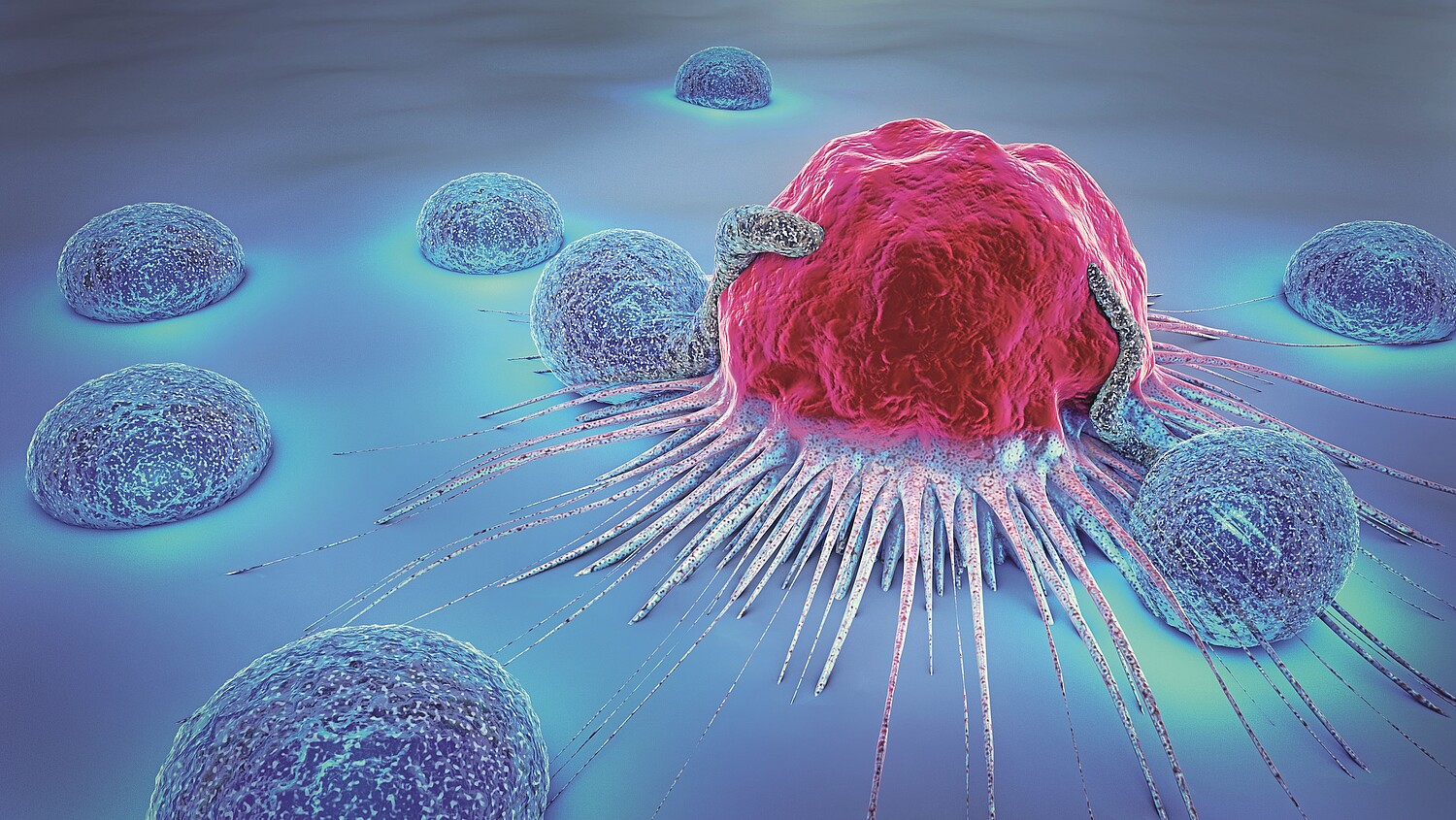
Die CAR-T-Zelltherapie (chimeric antigen receptor T-cell therapy) ist ein innovativer Ansatz in der Tumortherapie, der sich in den letzten Jahren rasant entwickelt hat. Die Anfänge der CAR-T-Zelltherapie reichen bis in die 1980er-Jahre zurück, als erste Versuche zur gentechnischen Modifikation von T-Zellen zur Tumorbekämpfung unternommen wurden. In den folgenden Jahrzehnten wurde die Technologie kontinuierlich weiterentwickelt und so weit optimiert, dass sie klinisch in spezialisierten Zentren im Rahmen der Tumortherapie eingesetzt werden kann. Vornehmlich werden derzeit Blutkrebserkrankungen behandelt (Leukämien, Lymphome und Myelome), die Entwicklung ist aber rasant und beinhaltet neben soliden Tumoren auch zunehmend Autoimmunerkrankungen.
Wirkprinzip der Therapie
CAR-T-Zellen werden in der Regel aus körpereigenen T-Zellen hergestellt. Deren natürliche Funktion, d. h. das Erkennen einer Zielstruktur (des sog. MHC-Peptid-Komplexes) auf fremden Zellen bzw. Tumorzellen mittels ihres T-Zell-Rezeptors, wird nicht verändert. Aber durch Einschleusen einer zellmembrangebundenen Antikörperdomäne (sog. CAR-Rezeptor) findet eine Umprogrammierung der T-Zellen ausserhalb des Körpers statt. Erkennt die Antikörperdomäne z. B. ein spezifisches Tumorantigen, so können die CAR-T-Zellen nach der Bindung an die Tumorzelle eine Reihe immunologischer Prozesse auslösen und die gezielte Zerstörung der Tumorzelle veranlassen.
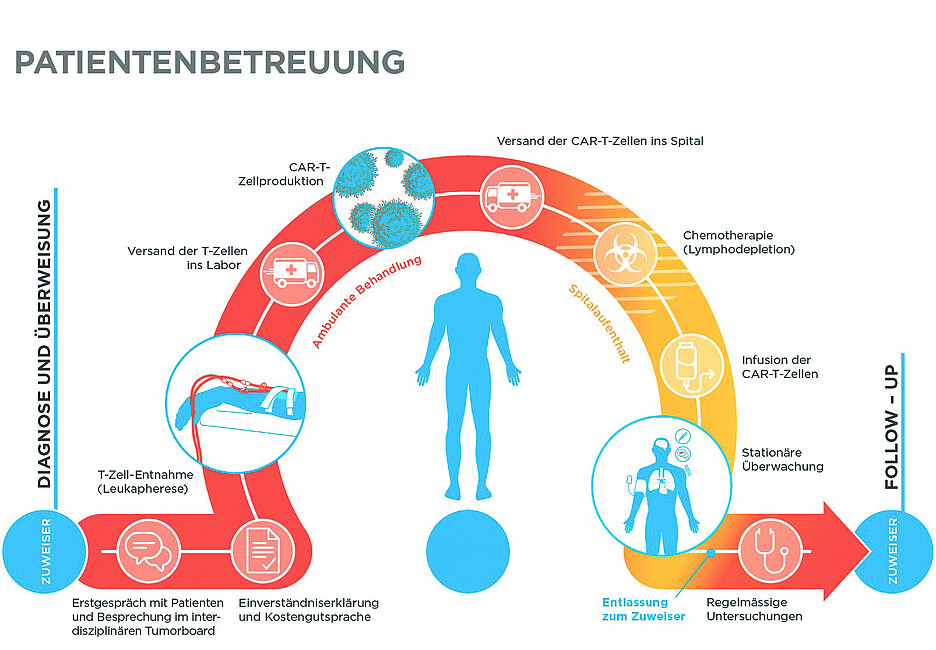
Herstellungsprozess von CAR-T-Zellen
Die Herstellung von CAR-T-Zellen ist ein komplexer mehrstufiger Prozess (Abb. 1):
- 1. Apherese: Entnahme von Leukozyten und damit T-Zellen (auch T-Lymphozyten genannt) aus dem Blut der Patientin bzw. des Patienten.
- 2. Gentechnische Modifikation: Die T-Zellen werden im Labor gentechnisch so verändert, dass sie den tumorspezifischen CAR-Rezeptor auf ihrer Oberfläche exprimieren.
- 3. Expansion und Aktivierung: Die CAR-T-Zellen werden im Labor vermehrt und aktiviert.
- 4. Reinfusion: Die CAR-T-Zellen werden nach einer Qualitätskontrolle vom Labor in die behandelnde Klinik zurückgeschickt und dort der Patientin bzw. dem Patienten infundiert.
Zulassung und Einsatzgebiete
Die erste CAR-T-Zelltherapie, Kymriah, wurde 2017 in den USA zur Behandlung der akuten lymphoblastischen Leukämie (ALL) bei Kindern und Jugendlichen zugelassen. In den folgenden Jahren folgten weitere Zulassungen in der Behandlung von B-Zell-Lymphomen und des Multiplen Myeloms (MM).
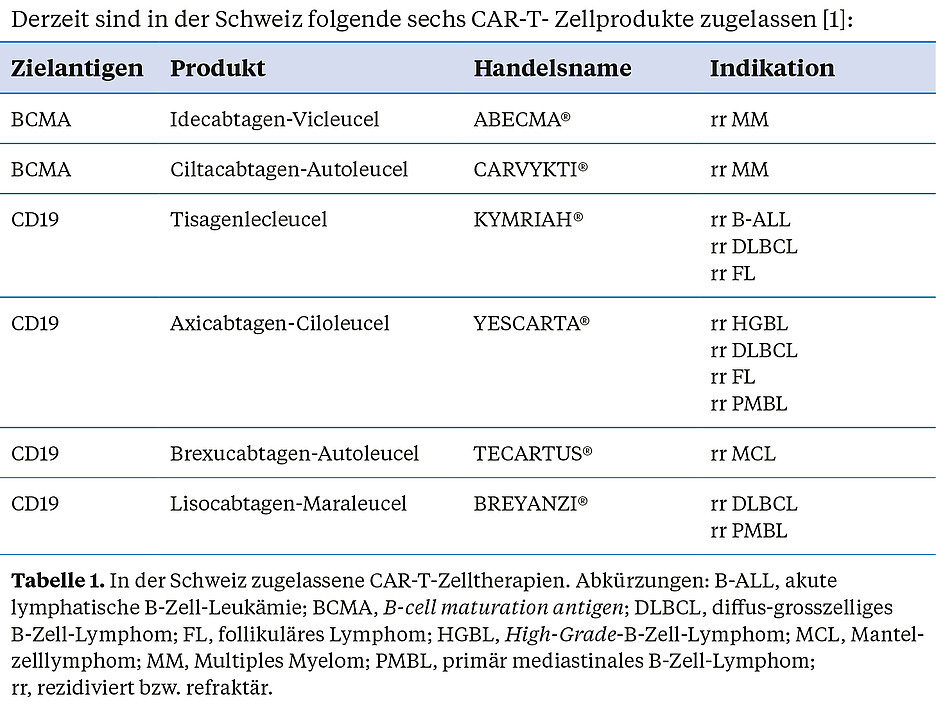
Derzeit sind in der Schweiz folgende sechs CAR-T- Zellprodukte zugelassen [1]:
Nebenwirkungen: von mild bis schwerwiegend
Die CAR-T-Zelltherapie kann mit einer Reihe von Nebenwirkungen verbunden sein, die von mild bis schwerwiegend verlaufen können [2]. Zu den häufigsten Nebenwirkungen gehören:
- Zytokin-Release-Syndrom (CRS): CRS ist eine systemische Entzündungsreaktion, die mit Fieber, Kopfschmerzen, Übelkeit und Erbrechen einhergehen kann.
- Neurologische Toxizität (ICANS): Neurologische Toxizität kann sich in Form von Verwirrtheit, Sprachstörungen, Krampfanfällen und Koma manifestieren.
- Hypogammaglobulinämie: Eine Hypogammaglobulinämie geht häufig mit einem erhöhten Infektionsrisiko einher und sollte bei rekurrenten Infekten mit Immunglobulinsubstitutionen behandelt werden.
Erfolgsaussichten der Behandlung
Für die Hauptindikationen des Erwachsenen (rr DLBCL, rr MM und rr MCL) gibt es aufgrund der Studien-, aber auch der sogenannten Real-world-Daten belastbare Zahlen bezüglich des Ansprechens, der Ansprechdauer sowie der Heilungschancen. Dabei unterscheiden sich Lymphome und Myelome bisher wie folgt:
- Die Chance auf eine Heilung (OS) liegt für rr DLBCL-Patienteninnen und -Patienten zwischen 35 und 50 Prozent und beim MCL bei knapp 60 Prozent. Berücksichtigt man, dass rr DLBCL- bzw. rr MCL-Betroffene bisher eigentlich keine bzw. nur eine sehr geringe (10 bis 15 Prozent) Heilungschance im Rezidiv hatten, so sind die CAR-T-Zell-Daten als eindeutige und relevante Weiterentwicklung in unserem therapeutischen Armamentarium anzusehen [3, 4, 5].
- In der Behandlung von rr MM-Patientinnen und -Patienten können mittels CAR-T-Zelltherapie sehr hohe Ansprechraten (häufig > 80 Prozent) mit einem zum Teil sehr langen Progressionsfreien Überleben (PFS) von > 2 Jahren erzielt werden. Leider gibt es bisher aber keinen Hinweis, dass langfristig auch Heilungen erzielt werden. Damit ist die CAR-T-Zelltherapie bisher bei rr MM-Betroffenen zwar lebensverlängernd, aber nicht heilend [6].
Ausblick und zukünftige Entwicklungen
Zu den wichtigsten Entwicklungszielen in der CAR-T-Zelltherapie gehören:
- Neue Krebsarten ins Visier nehmen: Ausweitung der CAR-T-Zellen zur Bekämpfung solider Tumore neben Lymphomen, Myelomen und Leukämien.
- Universelle CAR-T-Zellen: Entwicklung von Therapien «von der Stange». Dabei greift man auf T-Zellen eines gesunden Spenders zurück, schleust in diese den CAR-T-Zell-Rezeptor ein, vervielfältigt die T-Zellen in grossen Mengen und lagert sie entsprechend auf Vorrat. Somit kann man auf fertige CAR-T-Zellen eines Spenders (allogen) im Krankheitsfall zurückgreifen und muss nicht mehr individuell mit den körpereigenen T-Zellen (autolog) der Patientin bzw. des Patienten arbeiten.
- Verringerung der Nebenwirkungen: Minimierung von Risiken wie dem Zytokinfreisetzungssyndrom und Verbesserung der Patientenverträglichkeit. Erste Studien zeigen, dass somit auch eine rein ambulante Therapie möglich ist.
- Kombitherapien: Kombination von CAR-T-Zellen mit anderen immunologischen Behandlungen zur Verbesserung der Wirksamkeit.
- Behandlung von Autoimmunerkrankungen: CD19-spezifische CAR-T-Zellen können auch auto-reaktive B-Zellen eliminieren und damit z. B. B-Zell-abhängige Autoimmunerkrankungen effektiv behandeln, wie kürzlich das Beispiel einer Patientin mit systemischem Lupus erythematodes (SLE) gezeigt hat [7].
Fazit
Die CAR-T-Zelltherapie ist ein neuartiger und vielversprechender Ansatz in der Krebsbehandlung, der beeindruckende Ergebnisse bei Patientinnen und Patienten mit fortgeschrittenen Tumorerkrankungen erzielen konnte. Die Forschung in diesem Bereich ist sehr dynamisch, und es wird erwartet, dass in den kommenden Jahren weitere Verbesserungen der Technologie mit einem noch breiteren klinischen Einsatz einhergehen werden. Dabei werden sowohl Verbesserungen der Effektivität als auch der Verträglichkeit angestrebt, was eine zunehmend ambulante Behandlung erlauben würde.
Literatur
- https://www.swissmedic.ch/swissmedic/de/home/humanarzneimittel/authorisations/new-medicines.html
- Yakoub-Agha I, Chabannon C, Bader P, et al. Management of adults and children undergoing chimeric antigen receptor T-cell therapy: best practice recommendations of the European Society for Blood and Marrow Transplantation (EBMT) and the joint accreditation committee of ISCT and EBMT (JACIE). Haematologica. 2020;105(2):297–316.
- Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene Ciloleucel CAR-T cell therapy in refractory large B-cell lymphoma. N Engl J Med. 2017;377(26):2531–44.
- Wang M, Munoz J, Goy A, et al. KTE-X19 CAR-T cell therapy in relapsed or refractory mantlecell lymphoma. N Engl J Med. 2020a;382:1331–42.
- Schuster SJ, Bishop MR, Tam CS, Waller EK, Borchmann P, McGuirk JP, et al. Tisagenlecleucel in adult relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med. 2019b;380:45–56.
- Munshi NC, Anderson LD Jr, Shah N, Madduri D, Berdeja J, Lonial S, Raje N, Lin Y, Siegel D, Oriol A, et al. Idecabtagene Vicleucel in relapsed and refractory multiple myeloma. N Engl J Med. 2021;384(8):705–16.
- Mackensen A, Müller F, Mougiakakos D, Böltz S, Wilhelm A, Aigner M, Völkl S, Simon D, Kleyer A, Munoz L, Kretschmann S, Kharboutli S, Gary R, Reimann H, Rösler W, Uderhardt S, Bang H, Herrmann M, Ekici AB, Buettner C, Habenicht KM, Winkler TH, Krönke G, Schett G. Anti-CD19 CAR T cell therapy for refractory systemic lupus erythematosus. Nat Med. 2022 Oct;28(10):2124-2132. doi: 10.1038/s41591-022-02017-5. Epub 2022 Sep 15. Erratum in: Nat Med. 2022 Nov 3;: PMID: 36109639.